
一种用不混溶流体之间的界面构建微流控阵列的方法。
Introduction
思路:
微流控在主流生物实验室的应用仍受到如下限制:
- 材料不适合细胞生长;
- 结构封闭,开放性差;
- 实验期间不能更改预先设定的几何形状;
- 制造和操作成本高;
- 实验流程通常与现有生物实验流程不一致。
开放式微流控系统如悬浮、空气和纸微流控,往往需要建立新的基于活细胞的检测方法,不与传统生物学材料与方法兼容。
另一种开放的方法是在标准微孔板的孔内形成水凝胶壁,但需要在接种细胞前就构建好阵列。
更有生物学意义的方法是在生物学家传统培养皿上形成排列。
宏观世界中用液体壁创建结构的想法是行不通的——重力使它们坍塌成水坑。因此,在宏观尺度和大多数微流体装置中,液体被保持在具有实心壁的腔室中。然而,随着长度尺度变得更小,界面力主导重力,使类似于固体材料的流体界面限制液体成为可能。
作者开发了一种在培养皿上构建与重配置微流控阵列的方法,以适应细胞生物学中使用的一些主要工作流程。
Methodology
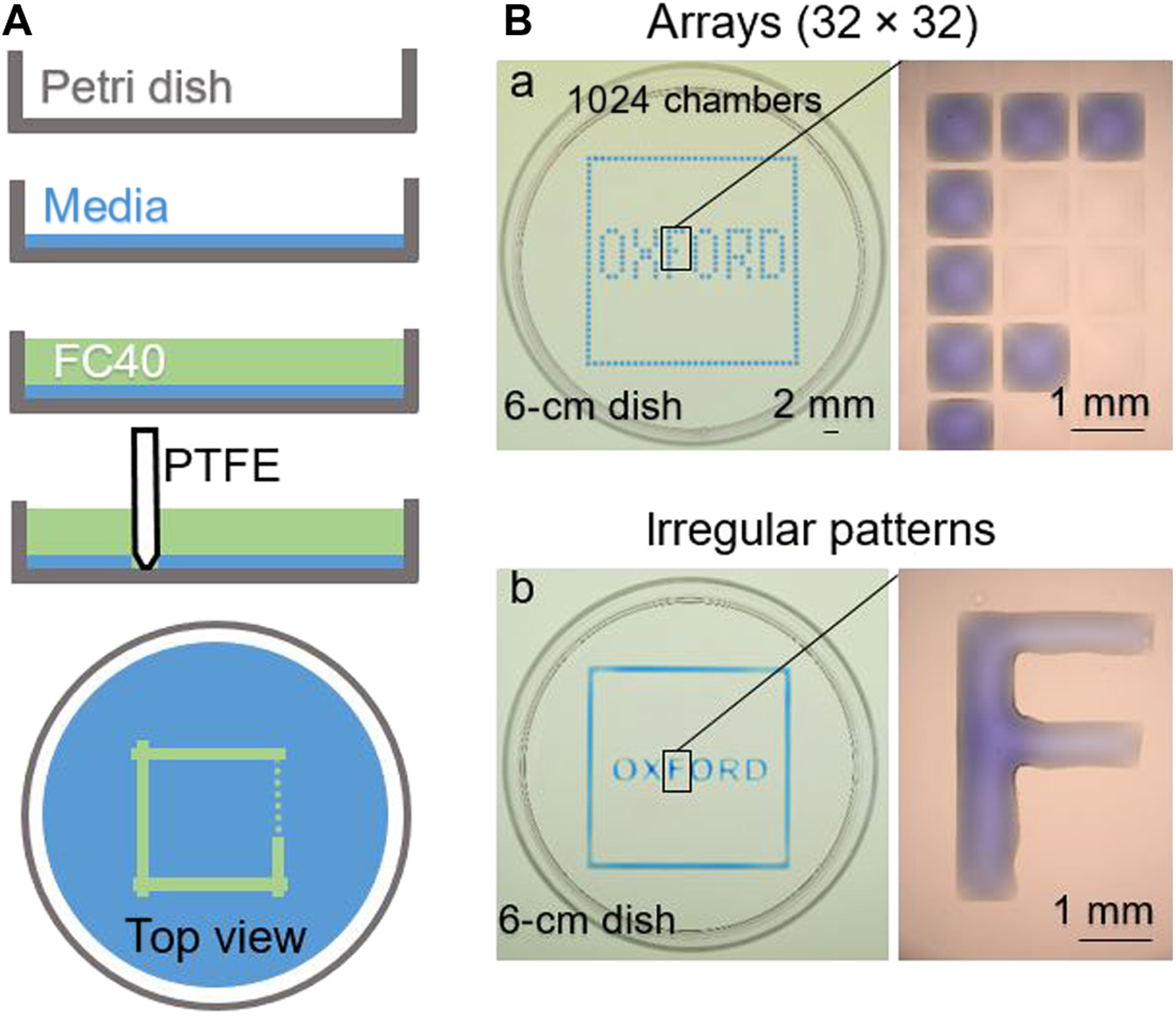
- (A)将DMEM+10%胎牛血清添加到培养皿中,随后去除大部分培养基,留下覆盖底部的薄膜,在其上覆盖不混溶的碳氟化合物FC40,以防止培养基蒸发,且保持无菌环境。疏水和亲氟的触控笔【其具有由聚四氟乙烯(PTFE)或“Teflon”制成的锥形尖端】在底部移动以形成正方形图案。由于碳氟化合物优先润湿Teflon(与水相比),FC40被带到基底上并置换水相(因为它也优先润湿基底)。
- (B)不同的模式:
- (a)等间距的垂直和水平线创建一个阵列。随后将60 nL蓝色染料添加到选定的腔室中;形成了外围为正方形框,内部为“OXFORD”字样的图案。放大图(右)显示了有/无染料的单个腔室。
- (b)用触控笔形成两个正方形(一个比另一个稍大),然后在中间的空间手动添加染料,从而创建类似的图案;每个字母都是通过形成其侧面并再次手动填充内部而制成的。放大图显示字母“F”是一团连续的液体。
Reconfiguring microfluidic arrangements

- (1)打印初始图案:由外围的正方形,中间的三角形以及内部的圆形构成;
- (2-4)在每个腔室中加入不同的染料,染料被限制在FC40壁内;
- (5)在圆圈中加入更多的黄色染料;
- (6)加入3 μL黄色染料后,圆形边界线破裂,内容物溢出到三角形中;
- (7)加入24 μL后,三角形边界线破裂,内容物溢出到方形中。
- (8)从正方形中抽出60 μL;
- (9)一个新的图案被打印出来:由外围的正方形,中间的圆形以及内部的三角形构成;
- (10-12)像上面一样在三个不同的腔室里加入彩色染料。这些结果表明,FC40液壁可以被破坏并重建成任何所需的二维形状,并且它们可以有效地限制液体。
Building fluid walls around single cells and clones

- (A)在单个腔室接种单细胞之前构建液壁。在制作网格后,加入染料或细胞(鼠乳腺癌细胞NM18)。由于FC40对O2和CO2自由渗透,因此不影响细胞生长。
- (a)红色染料(600 nL)被添加到每个腔室中,以展示网格。
- (b)将0.2 cells/600 nL的培养基添加到每个腔室(因此只有少数腔室有一个细胞),培养8天后对腔室进行成像,中央腔室含有一个克隆(见放大图)。
- (B)在单克隆细胞周围建液壁。
- (a)红色染料(1 μL)被添加到皿里的各种形状中;
- (b)HEK细胞接到一个皿里(密度~1 cells/cm2),生长8天成为克隆。接下来除去大部分培养基,在表面留下一层薄膜,加入FC40,在克隆周围画出各种形状,用打印机在每个腔室中注入1 μL的培养基,收集图像。
Clone picking

- (A)克隆挑选方法:
- (a)玻璃支架——“参考板”上的位置用独特的标识符(即A1,A2…,B1…)标记,用于细胞克隆定位;
- (b)在“参考板”上放置有菌落(红色)的培养皿;
- (c) 根据位置由程序在选定的克隆(黑线)周围打印出液壁;
- (d)从腔室中取出克隆。
- (B)隔离一个克隆,HEK细胞以低密度接种(密度~1 cells/cm2),培养8天成克隆,将皿放在“参考板”上,并在选定的克隆周围建立液壁。
- (a)带有独特标识符的“参考板”;
- (b)背景为“参考板”的克隆及放大视图;
- (c)构建液壁后的克隆。
- (C)克隆挑选:
- (a)图为围绕一个活的克隆建立的方形液壁,先通过添加/回收1 μL PBS来清洗细胞,然后添加1 μL胰蛋白酶;
- (b)37℃下5 min,使细胞从培养皿表面分离,回收1 μL细胞悬液;
- (c)将取回的细胞接种到12孔微孔板中,常规培养5天,细胞贴壁并生长。
Fluid walls are effective barriers to drugs

- (A)在一个3×3的网格中,中心加入1 μL培养基,周围的培养基则含有浓度为10 μg/mL的Puromycin(一种小分子翻译抑制剂,可以杀死哺乳动物细胞),孵育24 h后用台盼蓝评估细胞活力,外围的细胞已经死亡(每个腔室超过60%),而中央的细胞仍活着(细胞死亡少于5%)。
- (B)将0.5 μL的培养基±TNF-α(浓度10 ng/mL)加入到图案中。由于该HEK细胞编码一个由TNF-α开启的启动子控制的GFP报告基因,它们在暴露于该细胞因子时发出绿色荧光。荧光图像显示,只有被处理的体积中的细胞发出绿色荧光。这些结果表明,液壁对这些药物形成了有效的屏障,并允许对生长在同一皿中的细胞进行并列比较。
Wound healing
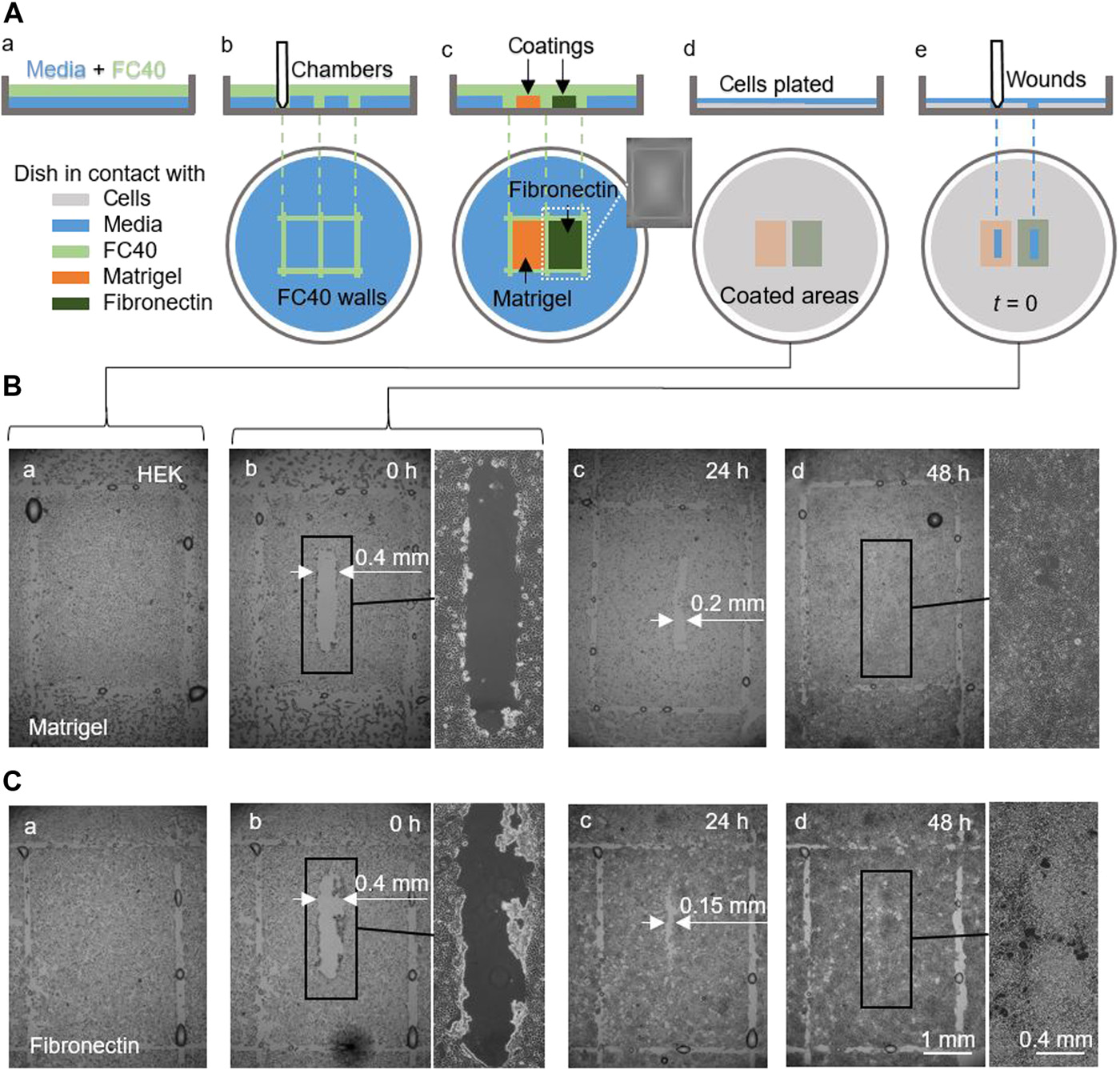
(A)工作流程的示意图:
- (a)一层薄薄的培养基上覆盖着FC40;
- (b)并排打印两个腔室;
- (c)在腔室中涂上Matrigel或fibronectin(2 μL,1 μg/cm2,1 h),插图为一个腔室的图像;
- (d)破坏液壁,用3 mL培养基清洗培养皿,以去除未附着的涂层,HEK细胞(6×105)被接种至培养皿中;
- (e)24 h后,细胞形成单层,在表面上刮开一个伤口(0.4 mm×2 mm),以去除其路径上的细胞,用显微镜监测伤口的愈合。
(B-C)生长在Matrigel(B)或fibronectin(C)上的单层细胞的伤口图像。
- (a-b)伤口形成前后的图像;
- (c)24 h后,细胞生长使Matrigel和fibronectin的伤口宽度分别减少到<0.2 mm和<0.15 mm;
- (d)48 h后,伤口完全愈合。结果表明,可以利用液壁很容易被破坏/重建这一特点在同一个培养皿中同时检测两个伤口的愈合。
Matrigel,基质胶是一种由肉瘤细胞分泌的胶状蛋白混合物,经常用于细胞侵袭的研究;
fibronectin,纤连蛋白是细胞外基质的一种糖蛋白,可增强伤口愈合。
Discussion
展示了一个用于细胞生物学工作流程的液壁微流控平台,进行了在粘附细胞周围形成微流控排列,然后用于如细胞克隆、药物筛选和伤口愈合的概念验证。优点在于:
- 可以在生物学家熟悉的细胞培养皿上构建复杂的微流控阵列,能支持复杂的工作流程,这与传统的方法形成了鲜明的对比,后者通常需要对生物测定进行调整以适应预先设计的微流控设备;
- 使用该平台制作的微流控阵列有流体壁/天花板,能准确地、可重复地建造;
- 该平台是高度灵活和可定制的;
- 用流体壁取代固体壁具有开放式微流控技术的好处,如由于FC40的光学透明性,且对移液器尖端没有阻碍,因此在整个实验过程中,阵列中的所有点都是完全可见和可访问的;
- 腔室周围的界限是稳定的;
- 微流控阵列可以在实验中实时重新配置。
限制在于:
- 阵列仅限于两个维度;
- 液体壁不可避免地比固体壁更脆弱;
- 液体和表面必须匹配,以确保有稳定的界限。
Reference
Soitu C, Feuerborn A, Deroy C, et al. Raising fluid walls around living cells[J]. Science Advances, 2019, 5(6): eaav8002.



